
Experimentele tehnice simple sunt foarte utile pentru copii, aceasta înseamnă să petreci timp împreună, să insufle abilități și să înțeleagă de către designeri mici, elementele de bază, că pâinile, ca în celebrul desen animat, nu cresc pe copaci.
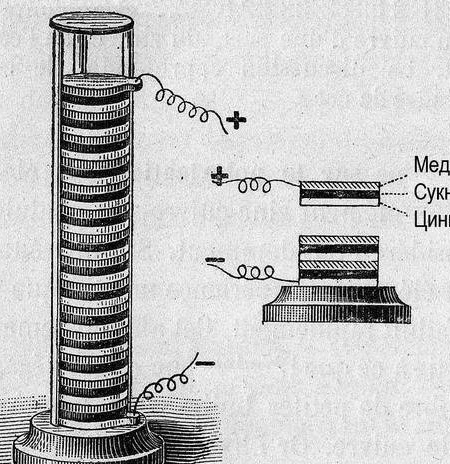
De data aceasta, am decis să facem cea mai simplă sursă de curent chimic și să încercăm să o aplicăm pentru orice lucru practic. Vorbind despre aplicații practice, merită să ne amintim că în urmă cu doar câteva generații, amatorii de radio, pentru a-și furniza receptoarele radio și amplificatoarele, au fost oferite să producă mai multe tipuri de celule galvanice sau baterii pentru producție independentă. Acestea sunt elementele din Leklanshe și Popov [1] p. 9 ... 18, sau o baterie cu gaz-potasiu sau cu gaz [1], p. 22 ... 28. Câteva elemente cu un curent relativ mare au fost conectate la o baterie incandescentă (filament incandescent de tuburi radio), zeci de elemente mai mici, la o baterie cu anod, a cărei tensiune ar putea atinge 60-80 volți. Bateriile erau „umede” - cu electrolit lichid și aveau nevoie de îngrijire și întreținere.
Astfel, celulă galvanică, câteva cuvinte „cum?” si "de ce?" Curentul electric apare atunci când metalele interacționează. În acest caz, apare o diferență de potențial diferită (tensiune). În 1793, Alessandro Volta, construind o celulă galvanică (Volta pol), a stabilit activitatea relativă a metalelor cunoscute atunci: Zn, Pb, Sn, Fe, Cu, Ag, Au. „Puterea” celulei galvanice s-a dovedit a fi mai mare, cu atât mai departe sunt metalele din acest rând (seria de tensiuni).

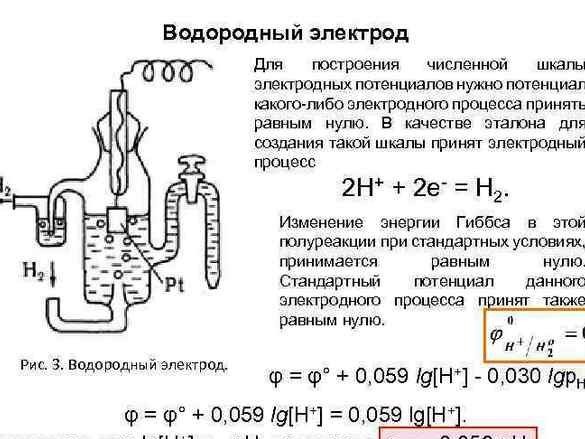
Ulterior, pentru organizarea datelor, potențialul „electrodului cu hidrogen” a fost luat ca referință zero. După măsurarea potențialului metalelor împerecheate cu el, metalele experimentale au fost aranjate la rând. Tabelul rezultat a fost denumit „Seria electrochimică a eforturilor metalice”, iar în camera de chimie, trebuie să stea lângă sistemul periodic și portretul lui Dmitri Ivanovici.

O serie de solicitări metalice sunt o contracție utilă, în cazul nostru, noi, ca Alessandro Volta, vom ști - cu cât mai multe metale vor fi separate unele de altele, cu atât tensiunea va fi mai mare.
În experimentele noastre, la fel ca clasicii, am folosit cupru și zinc.Când plăcile sunt cufundate într-un electrolit, între aceasta și placa de zinc, are loc o reacție chimică, ca urmare a căreia se acumulează sarcini negative pe placă și este încărcată negativ. Ca urmare a reacției care are loc în celula galvanică, electrodul de zinc se dizolvă treptat.
Pe un electrod de cupru, în timpul funcționării unei celule galvanice, se formează mici bule de hidrogen care izolează suprafața cuprului de electrolit. Fenomenul se numește, într-o celulă galvanică este dăunător, ei se luptă cu el. Pentru a elimina hidrogenul eliberat, substanțele numite hidrogen sunt introduse în electrolit. În rolul lor sunt adesea compuși de mangan, sulfat de cupru. În experimente simple, se poate utiliza permanganatul de potasiu din farmacie.
Ce am folosit pentru experiment.
Aparate și materiale.
Pentru asamblarea celulelor galvanice, ca electrozi de cupru, puteți utiliza sârmă, sârmă, folie. Zincul poate fi extras din elemente uscate, pot fi utilizate produse galvanizate. În loc de zinc, puteți încerca să utilizați un electrod din aluminiu sau fier. Clorură de sodiu pentru electrolit, un pic de sârmă moale de montare. Cu siguranță aveți nevoie de un voltmetru sau multimetru, tăietori de sârmă, foarfece. Ca vase, pot fi utilizate containere nemetalice de dimensiuni adecvate. Sticla, mai convenabilă decât cupele de plastic ușor - sunt mai grele, mai stabile, mai dificil de doborât. Este foarte bine dacă există o sarcină de joasă tensiune cu curent redus - un radio simplu, un ceas de cuarț etc.
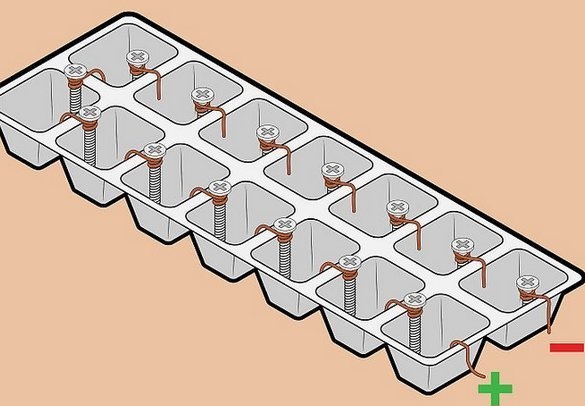
Baterie "de înaltă tensiune" din sârmă și șuruburi.
Fascinat de simplitatea detaliilor și de tensiunea relativ ridicată primită, am încercat să asamblăm o astfel de baterie. Aici se folosește o pereche de metale „clasice” - cupru-zinc. Ideea este să folosiți elemente de fixare zincate ca electrod de zinc. Gratios. Este clar că un astfel de element nu este conceput pentru funcționarea pe termen lung - un strat subțire de zinc se va dizolva rapid, cu toate acestea, acest lucru nu este important pentru un experiment pe termen scurt. Însă șuruburile sau butucurile galvanizate sunt peste tot pline.
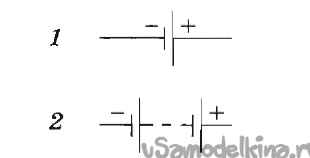
Un fir este, de asemenea, utilizat ca un electrod de cupru - de asemenea, un material disponibil pe scară largă, în plus - cea mai convenabilă instalare de elemente într-o baterie - toate elementele sunt conectate în serie - plus unul la minusul următor. În acest caz, tensiunea este însumată, curentul rămâne același.
Să începem.
După ce am selectat numărul necesar de elemente de fixare zincate cu lungimea dorită, am găsit un fir de cupru adecvat. Acesta este un fir de înfășurare în izolația lacului. Diametrul sârmei este de aproximativ 0,5 mm.

Polul curăță izolația de lac de mai multe ori, cu efortul de a trage sârmă printr-o piele de șlefuire dublu pliată, de dimensiuni medii.


Apoi, pregătește o pereche de electrozi - sub capul unui șurub cu auto-atingere, înfășoară strâns două sau trei rânduri de sârmă și taie excesul.

Ansamblul bateriei - un jgheab a fost folosit ca recipient pentru înghețarea gheții. Puteți utiliza celule din dulciuri în cutie, cu toate acestea, acestea sunt mai subtile. După instalarea electrozilor pe pereții dintre celule, umplem containerele cu electrolit. Am folosit o soluție de sare de masă - o lingură cu o lamă de 0,5 litri de apă caldă. Pentru umplere este foarte convenabil să folosiți o seringă medicală.


Am mai găsit câteva șuruburi pentru electrozi și am adăugat elemente la baterie, asta este ceea ce avem. Tensiunea la o sarcină cu impedanță ridicată (rezistența la intrare a unui voltmetru digital) este considerabilă, dar la orice sarcină, oricât de sesizabilă, scade semnificativ.
Încercați să faceți celulă galvanică similară (baterie) cu electrozi mai mari.
Ca recipient, am folosit un borcan de jumătate de litru (doi), plăci dintr-o suprafață considerabilă se vor încadra în el. Ca electrozi, am luat folie subțire de cupru și zinc - rămășițele unui pahar dintr-un element „uscat” din fabrică, dezasamblate în timpul producției de grafit pentru acoperire refractară.

Am curățat resturile de săruri cristaline uscate cu o perie de sârmă și am tăiat două farfurii cu foarfece cu aproximativ aceeași zonă. Din folie de cupru, tăiați două dungi potrivite. Tot cu foarfeca. Am obținut două perechi de electrozi, care ne-au echipat elementele, fără alte detalii, îndoindu-și marginile pe gâtul cutiei.


Într-un recipient mai mare, am pregătit un electrolit - clorură de sodiu, dizolvat în apă caldă, concentrația este aceeași, iar elementele preparate sunt turnate.


Am conectat cele două elemente în serie, folosind o bucată din sârmă de montare și două agrafe de crocodil. Deci, bine, tensiunea bateriei este aproape de "degetul" standard, încercați să utilizați. Un element cu o tensiune de 1,5 V este folosit într-un ceas electromecanic, în plus, consumul curent al ceasului este foarte mic, iar bateria noastră va putea să o supraîncălzească.

Am scos bateria standard din ceas și am conectat la terminale o bucată din firul de montare. Observând polaritatea (placa de cupru - "+", zinc - "-"), ne-am conectat ceasul la o baterie improvizată, voilă! Ceasul funcționează, tensiunea „se scufundă” la 1,3 V. Ceasul a funcționat perfect timp de câteva ore, până când ne-am lăudat cu toții (cu toate acestea, vrăjitor!), Atunci am obosit.

Spre pistă.
Constituția internă a oricărui copil este astfel încât atenția asupra unui subiect, el este capabil să se concentreze nu mai mult de 15 ... 20 de minute, iar toate clasele cu copii ar trebui să fie planificate astfel încât să se încadreze în acel moment, sau să comute între clase diferite, altfel veți fi amândoi chinuiți.
Ca sarcină, este mai bine să aplici dacă este în mișcare sau lumină - numerele de pe voltmetru impresionează mintea, dar nu și inima. În plus față de ceasuri și calculatoare, cu siguranță va provoca admirație, munca de la o baterie de casă a unui mic receptor radio (ca opțiune - una făcută acasă!).
Pentru utilizare pe termen lung, electrolitul celulelor trebuie protejat de praf și evaporare și să aibă grijă de depolarizator - bine, cel puțin înfundarea borcanului cu o bucată de folie de plastic cu o bandă elastică și adăugarea de permanganat de potasiu în electrolit. Mai mult, este mai bine să colectați imediat elementul menționat din Popov.
În afară de șuruburile autofiletante galvanizate, este posibil să folosiți oțel galvanizat, pentru elemente mari este mai convenabil - în timpul experimentului, puteți obține un curent semnificativ și alimentați orice (mișcând degetele în aer).
Lista literaturii folosite.
1. P. Strelkov. Cunoașteți și puteți. Pionier inginer electric. Detgiz. An 1960
2. V. S. Polosin, V. G. Prokopenko. Atelier pentru metodologia predării chimiei. Moscova, „Iluminarea”, 1989, p. 202.203.

